the collaborative network of the SARS-CoV-2 Assessment of Viral Evolution (SAVE) program of the National Institute of Allergy and Infectious Diseases (NIAID)のグループは、SARS-CoV-2 オミクロンは、マウスやハムスターの肺で減少していることが明らかとなり、ヒトの臨床データと合致していると報告しています。
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8722607/
幾つかの最近の研究(このブログでも紹介されています)は、オミクロンのSpikeタンパク質の変異がマウス宿主への適応を促進することを示しており、オミクロンの前駆細胞がヒトからマウスにジャンプし、次にヒトに戻ったと推測されます。これを支持するように、Wuhan-1 のRBDはマウスACE2に結合せず、オミクロンのRBDはマウスACE2に結合します。ハムスターはまた、SARS-CoV-2感染の影響を非常に受けやすく、COVID-19患者の肺組織で見られる病理学的な変化と同様な変化を示します。 そこで、著者らは、SAVE/NIAIDコンソーシアムの複数の研究所からの実験データを使用して、マウスとハムスターにおけるオミクロン株の感染性と病因についてサーベイしています。
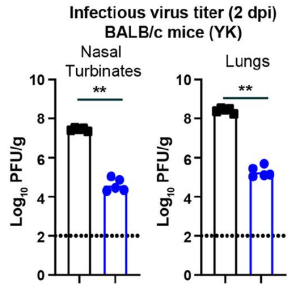
以下は、BALB/cマウスのオミクロンとベータ変異株の比較データです。感染後2日(dpi)で、鼻甲介と肺の感染性ウイルス存在量は、ベータと比較して、オミクロンに感染したBALB/cマウスで有意に低くなっていました(約1,000倍、P <0.001)。
デルタとオミクロンの間の3dpiでのハムスター組織における感染性ウイルス量の比較は、鼻甲介では実質的に違いはないが、ハムスターの肺におけるオミクロンの感染は実質的に少なくなっていました。
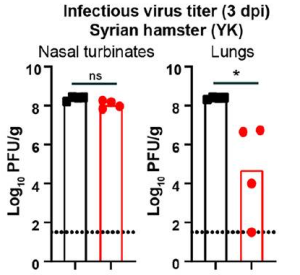
デルタまたはオミクロンに感染した後のハムスターの肺の病理の比較では、肉眼的には、デルタ感染ハムスターから得られた肺は、うっ血および/または出血を示しましたが、これは、オミクロン感染動物には見られませんでした。全体として、オミクロン変異株はハムスターの肺での複製効率が低く、デルタ変異株と比較して重症度の低い肺炎に留まるようです。
これらの実験結果は、他のSARS-CoV-2変異株(例えば、ベータまたはデルタ)と比較して、オミクロンの感染は、感染および/または疾患がマウスおよびハムスターで減弱されることを示唆しています。これらの結果は、オミクロンの伝染性は強いが、おそらくより軽度の呼吸器感染症に留まるということを示唆するヒトの予備的な臨床データと一致しているのですが、げっ歯類の弱毒化の根拠については、まだ良く分かっていません。
ある最近の研究(このブログでも紹介されています)は、オミクロンがヒトの鼻腔上皮でより速く複製し、肺細胞でより少なく複製することを報告しています。これらの観察結果がげっ歯類にまで及ぶかどうかは不明ですが、in vivoでのハムスター気管支細胞へののオミクロン感染は、デルタよりも少ないことが観察されますし、他のSARS-CoV-2変異株と比較して、オミクロンではマウスの鼻洗浄および鼻甲介におけるウイルス量が低下していることも分かりました。マウスへの適応が進んだ変異がオミクロンのRBDに沢山あることを考えると、ここで見られるオミクロンのマウスにおける弱毒化は予想外です。
オミクロンの30個を超える変異は受容体の関与と細胞侵入に影響を与える可能性がありますが、他のドメインにおける変異は複製などに影響を与える可能性があり、従って、詳細な遺伝的および機能的研究が、マウスおよびハムスターにおけるオミクロンのウイルス学的および臨床的弱毒化の基礎を明らかにするために必要です。